L’Esketamina è l’enantiomero S della ketamina racemica. Si tratta di un antagonista non selettivo e non competitivo del recettore N-metil-D-aspartato (NMDA), un recettore ionotropico glutammatergico. L’esketamina è stata approvata per l’uso nella “depressione resistente al trattamento” (definizione che comprende quei pazienti che non hanno risposto a due diversi trattamenti antidepressivi) negli Stati Uniti, in Europa e nel Regno Unito nel 2019. Una notizia che da alcuni è stata accolta con cautela, mentre altri ne hanno elogiato il nuovo impiego. D’altra parte, il National Institute for Health del Regno Unito e Care Excellence (NICE) ha pubblicato una bozza di linee guida nel gennaio 2020 raccomandando di non utilizzare l’esketamina per la depressione resistente al trattamento a causa della mancanza di prove di efficacia clinica e in termini di costi. Per questo è stata condotta una revisione sulle prove di efficacia e di sicurezza dell’esketamina negli studi presentati alla Food and Drug Administration (FDA) e ad altre agenzie regolatorie.
Complessivamente cinque studi sono stati presentati dall’azienda farmaceutica Janssen alla FDA per chiedere l’approvazione dell’esketamina come trattamento aggiuntivo per la ” depressione resistente alle terapie “: tre studi di efficacia, ciascuno della durata di 4 settimane, un discontinuation trial e uno studio di sicurezza della durata di 60 settimane.
La FDA normalmente richiede due trials di efficacia positiva per concedere in licenza un farmaco, “ciascuno convincente da solo”. Tuttavia, l’esketamina non ha soddisfatto nemmeno questo standard. Dei tre studi a breve termine condotti da Janssen solo uno ha mostrato una differenza statisticamente significativa tra esketamina e placebo. Questo studio ha rilevato una differenza di 4 punti sulla Montgomery – Åsberg Depression Rating Scale (MADRS) – che va da 0 a 60- favore dell’esketamina rispetto al placebo; tuttavia è stato riscontrato che una differenza di 4 punti corrisponde a un cambiamento inferiore al “minimo” sulla scala Clinical Global Impression (CGI) ed è un quarto della dimensione della risposta al placebo, suggerendo una dubbia rilevanza clinica.
Poiché la Janssen non è stata in grado di fornire due studi di efficacia positivi, la FDA ha allentato le sue regole e ha consentito un discontinuation trial per fornire prove di efficacia. Questo studio ha assegnato in modo casuale i pazienti che hanno dimostrato una “ remissione stabile ” dopo un trattamento con esketamina di 16 settimane (un gruppo altamente selezionato dei partecipanti) per continuare o interrompere l’esketamina e misurare la successiva ricaduta.
Questo disegno di studio ha rilevato notevoli problemi, in primis perché gli effetti di astinenza dal farmaco (da tempo noti) possono essere scambiati per ricaduta della depressione; in secondo luogo il fatto che lo studio non sia stato condotto in cieco; in terzo luogo la presenza di risultati definiti come “non robusti” a supporto di questo studio. Infine, alcuni autori hanno sostenuto che siano stati minimizzati i segnali sulla sicurezza – decessi (inclusi i suicidi), eventi avversi quali dissociazione, vertigini, aumento della pressione sanguigna, ipoestesia, nausea e sedazione, e segni di irritazione della vescica, quali infezioni del tratto urinario, dolore, disagio, cistite e nicturia -.
Poiché storicamente non era infrequente che un noto farmaco di uso improprio, associato a danni significativi, venisse sempre più promosso nonostante le scarse prove di efficacia e senza adeguati studi di sicurezza a lungo termine, gli autori concludono augurandosi che non si ripetano gli stessi errori del passato, e che vengano richiesti ulteriori studi di efficacia, che si presti adeguata attenzione ai danni dell’esketamina, e vengano richiesti dati di efficacia a lungo termine e solidi studi di sicurezza.
Bibliografia
- Mark A. Horowitz and Joanna Moncrieff, Are we repeating mistakes of the past? A review of the evidence for esketamine. Br J Psychiatry. 2020 May 27;1-4. doi: 10.1192/bjp.2020.89






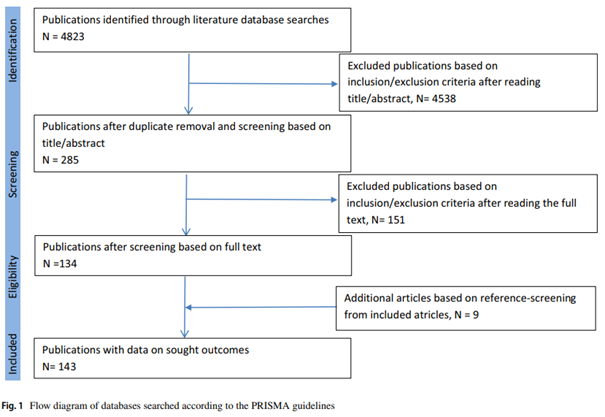


 Il gruppo di lavoro WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) ha appena pubblicato una meta-analisi su JAMA in cui si dimostra un risultato importante per la lotta alla malattia da coronavirus 2019 (COVID-19): la somministrazione di corticosteroidi sistemici, paragonata alla terapia standard o al placebo, è risultata associata con una minore mortalità per tutte le cause a 28 giorni nei pazienti critici affetti da COVID-19.
Il gruppo di lavoro WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) ha appena pubblicato una meta-analisi su JAMA in cui si dimostra un risultato importante per la lotta alla malattia da coronavirus 2019 (COVID-19): la somministrazione di corticosteroidi sistemici, paragonata alla terapia standard o al placebo, è risultata associata con una minore mortalità per tutte le cause a 28 giorni nei pazienti critici affetti da COVID-19.
 Un gruppo di ricercatori italiani afferenti all’Università di Verona in collaborazione con l’Agenzia Italiana del Farmaco ha utilizzato il Sistema Italiano di Farmacovigilanza per analizzare le reazioni avverse ai vaccini riportate in un periodo di 10 anni (2008 – 2017).
Un gruppo di ricercatori italiani afferenti all’Università di Verona in collaborazione con l’Agenzia Italiana del Farmaco ha utilizzato il Sistema Italiano di Farmacovigilanza per analizzare le reazioni avverse ai vaccini riportate in un periodo di 10 anni (2008 – 2017).