L’Agenzia europea per i medicinali (EMA) ha raccomandato il rilascio di un’autorizzazione all’immissione in commercio (AIC) subordinata a condizioni per COVID-19 Vaccine AstraZeneca per la prevenzione della malattia da coronavirus 2019 (COVID-19) nei soggetti di età pari o superiore a 18 anni. Si tratta del terzo vaccino anti-COVID-19 a cui l’Agenzia ha raccomandato il rilascio di una AIC.
Il comitato per i medicinali per uso umano (CHMP) dell’EMA ha condotto una rigorosa valutazione dei dati sulla qualità, la sicurezza e l’efficacia del vaccino e ha raccomandato, per consenso, il rilascio di una formale autorizzazione all’immissione in commercio subordinata a condizioni da parte della Commissione europea. Ciò assicurerà ai cittadini dell’UE che il vaccino rispetta gli standard europei e introduce le garanzie, i controlli e gli obblighi su cui fondare le campagne di vaccinazione a livello dell’Unione.
“Grazie a questo terzo parere favorevole, abbiamo ulteriormente ampliato il numero di vaccini a disposizione degli Stati membri dell’UE e del SEE per fronteggiare la pandemia e proteggere i cittadini”, ha dichiarato Emer Cooke, direttore esecutivo dell’EMA. “Come avvenuto in precedenza, il CHMP ha condotto una rigorosa valutazione del vaccino, e le basi scientifiche del nostro lavoro corroborano il nostro strenuo impegno a favore della salvaguardia della salute dei cittadini dell’UE”.
I risultati congiunti di 4 studi clinici condotti nel Regno Unito, in Brasile e in Sudafrica hanno dimostrato che COVID-19 Vaccine AstraZeneca era sicuro ed efficace nella prevenzione di COVID-19 in soggetti a partire dai 18 anni di età. Questi studi hanno coinvolto complessivamente circa 24.000 persone, metà delle quali ha ricevuto il vaccino, mentre l’altra metà ha ricevuto un’iniezione di controllo (iniezione fittizia o un altro vaccino non-COVID). I soggetti non erano a conoscenza di aver ricevuto il vaccino di studio o l’iniezione di controllo.
La sicurezza del vaccino è stata dimostrata in tutti e quattro gli studi. Tuttavia, l’Agenzia ha calcolato l’efficacia del vaccino sulla base dei risultati dello studio COV002 (condotto nel Regno Unito) e dello studio COV003 (condotto in Brasile). Gli altri due studi presentavano meno di 6 casi di COVID-19 ciascuno, e questo dato non è stato sufficiente per misurare l’effetto preventivo del vaccino. Inoltre, poiché il vaccino deve essere somministrato in due dosi standard e la seconda dose deve essere somministrata dalle 4 alle 12 settimane dopo la prima, l’Agenzia si è concentrata sui risultati che riguardavano persone che avevano ricevuto questo regime di somministrazione standard.
È emerso che il numero di casi sintomatici di COVID-19 si è ridotto del 59,5 % nei soggetti a cui era stato somministrato il vaccino (64 su 5.258 presentavano COVID-19 con sintomi), rispetto a quelli che avevano ricevuto l’iniezione di controllo (154 su 5.210 presentavano COVID-19 con sintomi). Ciò significa che negli studi clinici il vaccino ha dimostrato di essere efficace al 60% circa.
La maggior parte dei partecipanti agli studi in questione aveva tra i 18 e i 55 anni di età. Non sono ancora disponibili dati sufficienti relativi a partecipanti più anziani (oltre i 55 anni di età) per stabilire il grado di efficacia del vaccino in questa popolazione. Tuttavia, ci si aspetta la protezione, essendo stata osservata una risposta immunitaria in questa fascia di età e sulla base dell’esperienza ottenuta con altri vaccini. Poiché esistono informazioni affidabili sulla sicurezza in questa popolazione, gli esperti scientifici dell’EMA hanno ritenuto che il vaccino possa essere usato negli adulti più anziani. Sono attese maggiori informazioni dagli studi in corso che comprendono una percentuale più elevata di partecipanti anziani.
COVID-19 Vaccine AstraZeneca è somministrato come ciclo di due iniezioni nel braccio, a distanza di 4-12 settimane l’una dall’altra. Gli effetti indesiderati osservati più frequentemente con COVID-19 Vaccine AstraZeneca sono stati in genere di entità lieve o moderata e si sono risolti entro alcuni giorni dalla vaccinazione. Gli effetti indesiderati più comuni sono dolore e dolorabilità nel sito di iniezione, mal di testa, stanchezza, dolori muscolari, sensazione generale di malessere, brividi, febbre, dolore alle articolazioni e nausea. La sicurezza e l’efficacia del vaccino continueranno ad essere monitorate durante l’utilizzo in tutti gli Stati membri, attraverso il sistema di farmacovigilanza dell’UE e gli ulteriori studi condotti dall’azienda e dalle autorità europee.
Dove reperire maggiori informazioni
Le informazioni sul prodotto approvate dal CHMP per COVID-19 Vaccine AstraZeneca contengono informazioni sulla prescrizione destinate agli operatori sanitari, il foglio illustrativo per il pubblico e dettagli sulle condizioni dell’autorizzazione del vaccino.
La relazione di valutazione con i dettagli della valutazione di COVID-19 Vaccine AstraZeneca da parte dell’EMA e il piano di gestione del rischio completo saranno pubblicati entro pochi giorni. I dati degli studi clinici presentati dall’azienda nella domanda di autorizzazione all’immissione in commercio saranno pubblicati a tempo debito sulla pagina web Clinical datadell’Agenzia.
Maggiori informazioni sono disponibili in un documento generale sul vaccino destinato al pubblico, compresa una descrizione dei benefici e dei rischi del vaccino e dei motivi per cui l’EMA ne ha raccomandato l’autorizzazione nell’UE.
Meccanismo d’azione di COVID-19 Vaccine AstraZeneca
Ci si aspetta che COVID-19 Vaccine AstraZeneca predisponga l’organismo a difendersi contro l’infezione da coronavirus SARS-CoV-2. Il virus si serve delle proteine presenti sulla sua superficie esterna, denominate proteine spike, per penetrare all’interno delle cellule umane e diffondere la malattia
COVID-19 Vaccine AstraZeneca è costituito da un altro virus (della famiglia degli adenovirus) che è stato modificato in modo da contenere il gene responsabile della produzione della proteina spike del SARS-CoV-2. L’adenovirus di per sé non è in grado di replicarsi e non provoca la malattia. Una volta iniettato, il vaccino provvede a diffondere il gene del SARS-CoV-2 nelle cellule dell’organismo. A quel punto, le cellule utilizzano il gene per produrre la proteina spike. Il sistema immunitario della persona vaccinata riconoscerà questa proteina come estranea e risponderà producendo le proprie difese naturali (ossia gli anticorpi e le cellule T). Qualora, in un momento successivo, la persona vaccinata dovesse entrare in contatto con il SARS-CoV-2, il suo sistema immunitario riconoscerà il virus e sarà pronto a combatterlo: anticorpi e cellule T possono lavorare insieme per uccidere il virus, prevenirne l’ingresso nelle cellule dell’organismo e distruggere quelle infette, contribuendo pertanto a proteggere la persona contro COVID-19.
Autorizzazione all’immissione in commercio subordinata a condizioni
La Commissione europea accelererà il proprio processo decisionale in modo da emettere una decisione sull’autorizzazione all’immissione in commercio subordinata a condizioni per COVID-19 Vaccine AstraZeneca, e consentire di effettuare le campagne vaccinali nell’UE.
L’autorizzazione all’immissione in commercio subordinata a condizioni è uno degli strumenti previsti dalla legislazione dell’UE per rendere prioritaria la procedura di autorizzazione per la rapida approvazione di trattamenti e vaccini durante situazioni di emergenza per la salute pubblica.
Un’AIC subordinata a condizioni garantisce che il vaccino è conforme ai rigorosi standard dell’UE in materia di sicurezza, efficacia e qualità e che è prodotto e controllato in impianti certificati approvati, in linea con gli elevati standard farmaceutici compatibili con la commercializzazione su vasta scala. Le AIC subordinate a condizioni consentono di autorizzare i medicinali che rispondono a un’esigenza medica non soddisfatta sulla base di dati meno completi di quelli normalmente richiesti. Ciò accade se il beneficio per il paziente derivante dall’immediata disponibilità di un medicinale o di un vaccino supera il rischio inerente al fatto che non tutti i dati sono ancora disponibili. Tuttavia, i dati devono dimostrare che i benefici del medicinale o del vaccino superano i rischi.
Una volta rilasciata l’autorizzazione all’immissione in commercio subordinata a condizioni, AstraZeneca dovrà fornire ulteriori dati dagli studi in corso entro termini predefiniti per confermare che i benefici continuano a superare i rischi. L’azienda condurrà inoltre studi volti a fornire garanzie aggiuntive sulla qualità farmaceutica del vaccino in seguito all’aumento della produzione.
Monitoraggio della sicurezza di COVID-19 Vaccine AstraZeneca
In linea con il piano di monitoraggio della sicurezza dell’UE per i vaccini COVID-19, COVID-19 Vaccine AstraZeneca sarà sottoposto ad attento monitoraggio e sarà oggetto di una serie di attività relative specificamente ai vaccini anti-COVID19. Sebbene nell’ambito degli studi clinici un numero elevato di persone abbia ricevuto i vaccini COVID-19, alcuni effetti indesiderati possono emergere solo quando si saranno vaccinate milioni di persone.
Le aziende dovranno forniranno relazioni mensili sulla sicurezza oltre ad aggiornamenti periodici richiesti dalla legislazione, e condurranno studi per monitorare la sicurezza e l’efficacia dei vaccini nel momento in cui sono somministrati al pubblico. In aggiunta, studi indipendenti sui vaccini anti-COVID-19 , coordinati dalle autorità dell’UE, forniranno informazioni aggiuntive sulla sicurezza e sui benefici a lungo termine del vaccino per la popolazione in generale.
Queste misure consentiranno alle autorità regolatorie di valutare rapidamente i dati provenienti da una serie di fonti diverse e di adottare, se necessario, misure regolatorie adeguate per proteggere la salute pubblica.
Valutazione di COVID-19 Vaccine AstraZeneca
Durante la valutazione di COVID-19 Vaccine AstraZeneca, il CHMP ha ricevuto il supporto del comitato di valutazione dei rischi per la farmacovigilanza (PRAC) dell’EMA, che ha esaminato il piano di gestione del rischio di COVID-19 Vaccine AstraZeneca, e della task force EMA contro la pandemia da COVID-19 (COVID-ETF), che riunisce gli esperti della rete delle agenzie regolatorie europee per agevolare un’azione regolatoria rapida e coordinata sui medicinali e i vaccini anti-COVID-19.






 Il gruppo di lavoro WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) ha appena pubblicato una meta-analisi su JAMA in cui si dimostra un risultato importante per la lotta alla malattia da coronavirus 2019 (COVID-19): la somministrazione di corticosteroidi sistemici, paragonata alla terapia standard o al placebo, è risultata associata con una minore mortalità per tutte le cause a 28 giorni nei pazienti critici affetti da COVID-19.
Il gruppo di lavoro WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) ha appena pubblicato una meta-analisi su JAMA in cui si dimostra un risultato importante per la lotta alla malattia da coronavirus 2019 (COVID-19): la somministrazione di corticosteroidi sistemici, paragonata alla terapia standard o al placebo, è risultata associata con una minore mortalità per tutte le cause a 28 giorni nei pazienti critici affetti da COVID-19.
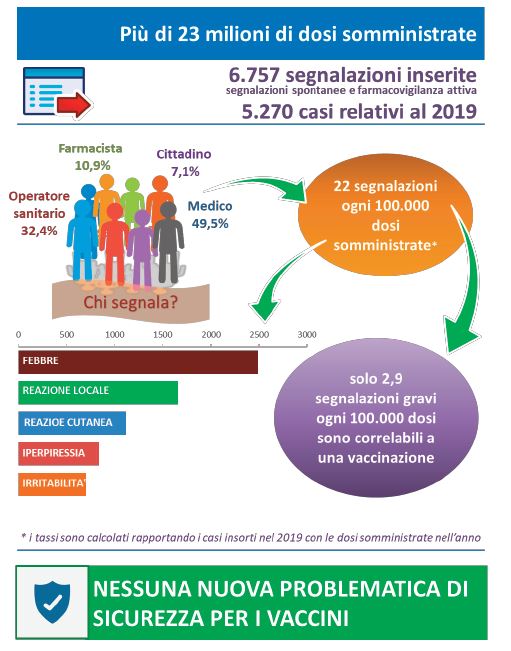
 Un gruppo di ricercatori italiani afferenti all’Università di Verona in collaborazione con l’Agenzia Italiana del Farmaco ha utilizzato il Sistema Italiano di Farmacovigilanza per analizzare le reazioni avverse ai vaccini riportate in un periodo di 10 anni (2008 – 2017).
Un gruppo di ricercatori italiani afferenti all’Università di Verona in collaborazione con l’Agenzia Italiana del Farmaco ha utilizzato il Sistema Italiano di Farmacovigilanza per analizzare le reazioni avverse ai vaccini riportate in un periodo di 10 anni (2008 – 2017).
 Vi è attualmente una crescente necessità globale di formazione in farmacovigilanza che non può essere soddisfatta con i tradizionali corsi in presenza. Per tale motivo l’Uppsala Monitoring Centre (UMC) dell’OMS ha sviluppato vari moduli di e-learning.
Vi è attualmente una crescente necessità globale di formazione in farmacovigilanza che non può essere soddisfatta con i tradizionali corsi in presenza. Per tale motivo l’Uppsala Monitoring Centre (UMC) dell’OMS ha sviluppato vari moduli di e-learning.