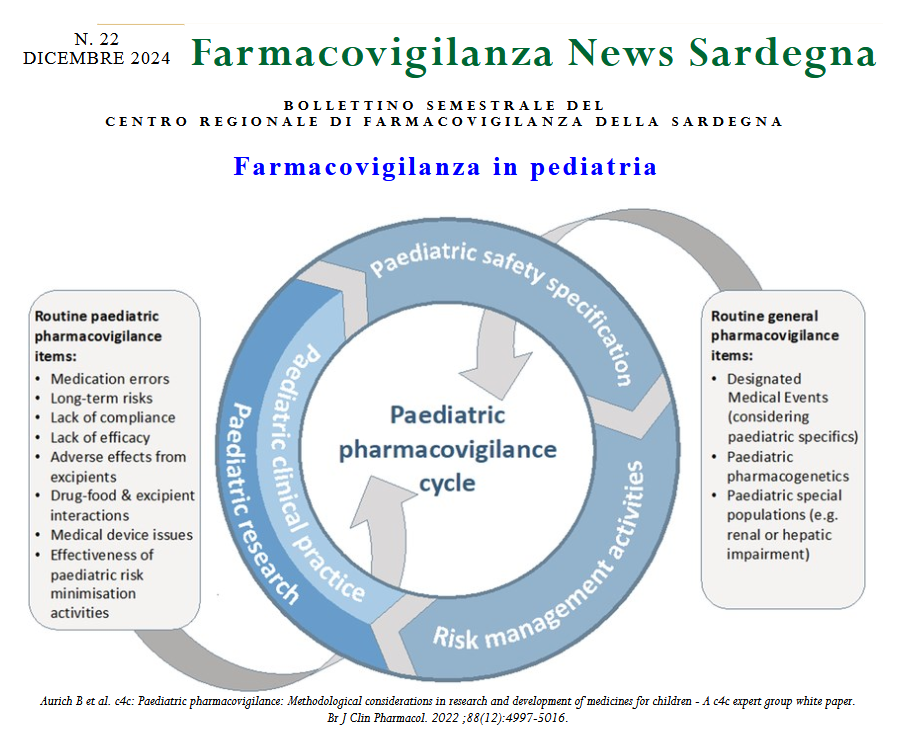
Vi riportiamo un lavoro presentato per il XXXIII Seminario Nazionale dell’Istituto Superiore di Sanità “La valutazione dell’uso e della sicurezza dei farmaci: esperienze in Italia” sull’uso dei farmaci biologici per malattie infiammatorie immuno-mediate in pediatria.
Introduzione. L’introduzione di farmaci biologici ha rivoluzionato il trattamento delle malattie infiammatorie immuno-mediate (IMID, Mediated Inflammatory Diseases) in pediatria, soprattutto in ambito reumatologico, gastroenterologico e dermatologico, sebbene le evidenze nella pratica clinica rimangano limitate. L’obiettivo di questo studio di farmacoutilizzazione è valutare l’uso di farmaci biologici approvati in pazienti pediatrici affetti da malattie infiammatorie immuno-mediate negli anni 2010-2023, utilizzando i dati del network distribuito multiregionale del progetto VALORE.
Metodi. È stato condotto uno studio di coorte retrospettivo utilizzando i dati di 14 regioni italiane che tramite TheShinISS hanno elaborato a livello locale i dati amministrativi trasformati in common data model e condiviso dataset anonimizzati. Come coorte di studio sono stati selezionati gli utilizzatori prevalenti dei farmaci biologici nelle IMID e di età <18 anni. Successivamente, sono stati individuati gli utilizzatori incidenti (nessun utilizzo di farmaco biologico nell’anno precedente la data di inizio follow-up). È stata calcolata la prevalenza d’uso dei farmaci biologici al 2022, stratificata e aggiustata per anno di calendario, sesso, e classe d’età. È stata poi effettuata un’analisi descrittiva degli utilizzatori incidenti, stratificata per classe d’età (1-5, 6-11, 12-17) ed infine è stata calcolata la persistenza al trattamento per le indicazioni d’uso più frequenti.
Risultati. Dal 2010 al 2023, nelle 14 regioni italiane, sono stati identificati 7.836 utilizzatori pediatrici di farmaci biologici. Di questi, 6.224 (79,4%) erano utilizzatori incidenti. La prevalenza d’uso annuale è cresciuta negli anni ed è risultata costantemente più elevata tra le femmine (da 14,8 a 71,1 per 100.000 abitanti) rispetto ai maschi, e tra gli adolescenti (da 14,6 a 106,9 per 100.000 abitanti) rispetto ai bambini. Tra gli utilizzatori incidenti, quasi due terzi erano adolescenti (61,8%) e la maggior parte erano femmine (F/M: 1,2). L’artrite idiopatica giovanile (2.238, 36,0%) e le malattie infiammatorie croniche intestinali (2.234, 35,9%) sono state le indicazioni d’uso più riportate. La maggior parte dei soggetti con artrite idiopatica giovanile ha iniziato il trattamento con etanercept (50,8%) o adalimumab (40,1%), mentre i soggetti con malattie infiammatorie croniche intestinali utilizzavano principalmente infliximab (55,0%) o adalimumab (44,3%). Durante il primo anno, più del 70% dei soggetti con artrite idiopatica giovanile e circa il 60% di soggetti con malattie infiammatorie croniche intestinali era ancora persistente al trattamento.
Conclusioni. L’utilizzo di farmaci biologici tra pazienti pediatrici affetti da malattie infiammatorie croniche immuno-mediate è fortemente aumentato nell’ultimo decennio. È necessario implementare un monitoraggio di larga scala a lungo termine. Le reti distribuite di banche dati amministrative regionali rappresentano uno strumento idoneo per tale scopo.
Bellitto Chiara (a), Soardo Federica (a), Ingrasciotta Ylenia (a), Spini Andrea (a), L’Abbate Luca (a), Mathieu Clément (a), Pellegrini Giorgia (a), Carollo Massimo (a), Gallizzi Romina (b), Leoni Olivia (c), Mazzone Arianna (d), Ancona Domenica (e), Stella Paolo (e), Cavazzana Anna (f), Scapin Angela (f), Lopes Sara (g), Belleudi Valeria (g), Ledda Stefano (h), CartaPaolo (h), Rossi Paola (i), Ejlli Lucian (i), Sapigni Ester (j), Puccini Aurora (j), Scarpelli Rita Francesca (l), De Sarro Giovambattista (l), Tuccori Marco (m), Gini Rosa (n), Allotta Alessandra (o), Addario Pollina Sebastiano (o), Bucaneve Giampaolo (p), Mangano Antea Maria Pia (g), Balducci Francesco (g), Sorrentino Carla (r), Senesi Ilenia (s), Costa Giorgio (t), Urru Silvana Anna Maria (t), Campomori Annalisa (t), Trama Ugo (u), Bernardi Francesca Futura (v), Da Cas Roberto (w), Spila Alegiani Stefania (w), Massari Marco (w), Trifirò Gianluca (a)
a) Dipartimento di Diagnostica e Sanità Pubblica, Università degli Studi, Verona
(b) Unità Pediatrica, Dipartimento Scienze della Salute, Università degli Studi Magna
Graecia, Catanzaro
(c) Centro Regionale Farmacovigilanza e Osservatorio Epidemiologico Regionale, Regione
Lombardia, Milano
(d) Azienda Regionale per l’Innovazione e gli Acquisti S.p.A, Milano
(e) Centro Regionale Farmacovigilanza Regione Puglia, Bari
(f) Azienda Zero, Regione Veneto, Padova
(g) Dipartimento di Epidemiologia, Servizio Sanitario Regionale, Regione Lazio, Asl Roma
1, Roma
(h) Regione Autonoma della Sardegna, Cagliari
(i) Centro Regionale Farmacovigilanza Regione Friuli-Venezia Giulia, Trieste
(j) Centro Regionale Farmacovigilanza Regione Emilia-Romagna, Bologna
(k) Dipartimento Salute e Welfare, Regione Calabria, Catanzaro
(l) Università degli Studi Magna Graecia, Catanzaro
(m)Unità Monitoraggio Reazioni Avverse ai Farmaci, Ospedale Universitario, Pisa
(n) Agenzia Regionale di Sanità Toscana, Firenze
(o) Osservatorio Epidemiologico Regiona Sicilia, Palermo
(p) Centro Regionale Farmacovigilanza Regione Umbria, Perugia
(q) Agenzia Regionale Sanitaria Regione Marche, Ancona
(r) Ufficio Monitoraggio Spesa Farmaci e Dispositivi Medici, Regione Abruzzo, Pescara
(s) Centro Regionale Farmacovigilanza Regione Abruzzo, Teramo
(t) Unità Farmacia Ospedaliera, Azienda Provinciale per i Servizi Sanitari, Trento
(u) Unità Farmaceutica Regionale, Regione Campania, Napoli
(v) Dipartimento di Parmacologia, Università della Campania Luigi Vanvitelli, Ospedale
Monaldi, Napoli
(w) Centro Nazionale per la Ricerca e la Valutazione Preclinica e Clinica dei Farmaci,
Istituto Superiore di Sanità, Roma